Antineoplastik kemoterapide ilaç etkinliği kısıtlayan faktörler:
 Tümör-ilaç etkileşimi: Tümör büyüdükçe ilaca olan duyarlılık azalır. Ayrıca döneme spesifik olmama bir dezavantajdır.
Tümör-ilaç etkileşimi: Tümör büyüdükçe ilaca olan duyarlılık azalır. Ayrıca döneme spesifik olmama bir dezavantajdır. - İlacın farmakokinetiği ve farmakolojisi ile ilgili faktörler: ilacın konsantrasyonu, doz kısıtlayan toksisiteye sahip oluşu, malign hücrelerde membran yapısında değişiklik sonucu hücre membranında ilaç geçirgenliğinin azalması.
- İaca rezistans gelişimi
- Hasta ile ilgili faktörler: Hastanın yaşı, cinsiyeti, ırkı v.b.
Antineoplasitk ajan uygulama yolları
1-Oral yol
2- İntravenöz yol (i.v.): En çok uygulanan yoldur.
Üç şekilde i.v. uygulama yapılır:
1. i.v. bolus, puşe ( ilaç 10-20 ml fizyolojik serumla sulandırılır ve 5-10 dakikada uygulanır)
2. i.v. kısa infüzyon ( 50-100 ml çözeltide sulandırılır, 10-30 dakikada uygulanır)
3. i.v. yavaş infüzyon ( 250-1000 ml fizyolojik serumla sulandırılır ve 1 saat ya da daha uzun sürede uygulanır)
Bazı ilaçlar 24 saat ya da daha uzun sürelerde sürekli infüzyon şeklinde de uygulanabilir.
3- İntratekal yol: (omurilik kanalına veya subaraknoid boşluğa enjeksiyon yoluyla ilaçlar için bir uygulama yoludur) Leptomeningeal tutulumda tedavi ve santral sinir sistemi profilaksisinde kullanılır. Antineoplastik ilacın BOS'a yeterli konsantrasyonda ulaşamaması ve terapötik etkinin zayıf olması durumunda tercih edilir. İntratekal uygulamada metotreksat ve sitozin arabinozid en sık seçilen ilaçlardır. Bu yöntem için ilaçların koruyucusuz hazırlanmış formları kullanılmalıdır.
4- İntrakaviter yol: Periton, plevra, perikard ve mesane gibi boşlukların içine iğne ya da özel kateterler aracılığıyla kanser ilaçlarının uygulanmasıdır. Amaç genellikle bu seröz ya da organlara ait boşluklarda bulunan hastalık için, etkili ilacın bu bölgelerde daha yüksek konsantrasyonda ve daha uzun süreli bulunmasının sağlanarak, terapötik etkinliğin arttırılmasıdır. Diğer amaç plevra için intraplevral verilen bazı ajanlarla plörodezis (yapay tıkama) oluşturmaktır.
5- İntraarteriyel yol: Bu uygulamada amaç, tümörü besleyen arter içine antineoplastik ilaçların verilmesi ile daha yüksek konsantrasyonda ilaç düzeyi sağlanarak, terapötik etkinliğin arttırılmasıdır.
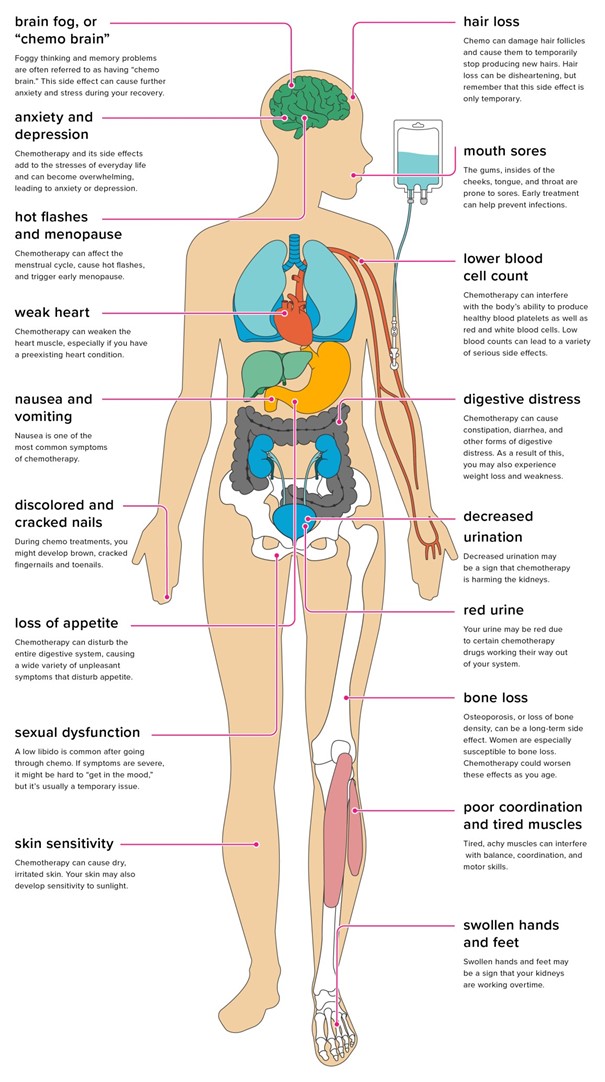
Şekil: https://www.healthline.com/health/cancer/effects-on-body
ANTİNEOPLASTİK AJANLARIN YAN ETKİ VE TOKSİSİTELERİ
- Kemik iliği supresyonu (döneme özgü ilaçlar lökopeni, döneme özgü olmayanlar kemik iliği supresyonu yapar)
- Hızlı çoğalan normal hücrelerin inhibisyonu (GI kanal epitel hücreleri inhibe eder ve stomatit, ülser, enterite neden olur. Kıl dökülmesi ve kısırlık yapabilir.
- Lenfositik etki ve immunosupresyon:
- Teratojenik etki
- Mutajenik ve karsinojenik etki
- Bulantı, kusma, doku nekrozu
- HEMATOLOJİK TOKSİSİTE
Kemik iliği baskılanması başta olmak üzere tüm hematolojik komplikasyonları içerir. Hemen hemen hepsinde görülür. 3 mekanizma vardır
- Nötropeni (granülositopeni)
- National Cancer Instute tarafından önerilen sisteme göre nötropeni 2000/mm 3 ‘ün altındaki nötrofil sayısıdır.
- Nötrofil sayısını 500/mm 3 ‘ün altında olması durumuna ciddi nötropeni (grade 4) denir.
- Kemoterapötik ajanların çoğunda nötropeni, ilacın uygulanmasından 7-14 gün sonra gelişir ve 21-28. günlerde kaybolur.
- Ancak nitrozüreler, mitomisin C, dakarbazin ve prokarbazin gibi ilaçlarda gecikmiş kemik iliği baskılanması görülür. Bu ajanlarda tedavinin 21-48. günlerinde nötropeni ortaya çıkar ve düzelme 28-56. günlerde olur.
- Pek çok ajan için geçicidir ama busulfan uygulamalarında bazan irreversibl olabilir.
- Nötropeni hastalarda enfeksiyon riskini arttırır. Febril nötropenide sepsis ya da bakteriyemi sonucu ölüm bile görülebilir.
- Lenograstim ve filgrastim gibi imunomodülatör ajanlarla tedavi edilebilir. (koloni stimule edici faktör)
- Trombositopeni,
- Nötropeniden daha az görülür.
- Ortaya çıkışı ve düzelme süreleri nötropeni ile benzerdir.
- Trombositopeni 100 000/mm 3‘ün altındaki trombosit sayısıdır. Bu sorun da yaşamı tehdit edebilir, trombositleri 20 000/mm 3‘ün altında olan hastalarda ciddi kanama olasılığı yüksektir. Bu durumda kanamalar önce ciltte purpurik döküntüler şeklindeyken, trombositopeni derinleştikçe dişeti kanamaları, epistaksis ya da gastrointestinal sistemden kanama gibi mukoza kanamaları ve seyrek de olsa santral sinir sistemi kanamaları gibi ölümcül olabilecek klinik durumlar görülebilir.
- Ciddi trombositopeni ya da kanama durumlarında tek etkin yöntem, trombosit infüzyonudur.
- Anemi
- Kemoterapiye bağlı anemi eritrositlerin yaşam süresinin uzun olması nedeniyle, genellikle geç dönemde görülür. Platin grubu ajanlarda anemi, kemik iliği baskılanmasından çok eritropoietin yapımının bozulması ile ortaya çıkabilir.
- Anemi tedavisinde, gerektiğinde kan transfüzyonu ve bazen eritropoietin uygulanabilir.
- GASTROİNTESTİNAL TOKSİSİTE
- Bulantı-kusma ve iştahsızlık:
- Kemoreseptör-triger zon, dopamin ve serotonin üzerine beliren bir yan etkidir.
- Kanser ilaçları ayrıca iştahsızlık, bazı gıdalardan tiksinme, kokulara karşı duyarlılık ve ağızda kötü tad gibi hastaların beslenmesini bozan ve kilo kaybına yol açabilen toksisitelere neden olabilir.
- Mukozit: Gastrointestinal sistemin epiteli üzerindeki toksisitesidir. Ağızdan anal bölgeye dek uzanabilir. Stomatit, diyare, özefajit ve gastrittir bunlardan bazılarıdır.
- Kabızlık: Periferik nöropatinin otonom sinir sisteminde en sık görülen belirtisidir.
- Karaciğer toksisitesi: Enzim yükselmesi, fibrozis ve siroz, kolestaz şeklinde görülebilir.
- CİLT TOKSİSİTESİ
Ekstravazasyon
- Vezikan ilaçlar hiçbir zaman damar dışı yolla uygulanamaz ve intravenöz uygulamada çok dikkatli davranılması zorunludur.
- Aktinomisin D ve antrasiklinler (doksorubisin) şiddetli vezikan etki gösteren ilaçlardır. Nitrojen mustard, mitomisin C, taksol ve vinkalar (vinkristin, vinblastin)ise daha az vezikan etki gösteren ilaçlardır.
- Lokal eritemden nekroza kadar gidebilir.
- Vezikan ilaçların uygulanması sırasında eğer kalıcı katater kullanılmıyorso, iyi bir periferik damar yolu seçilmelidir.
- İlaç mümkün olduğu kadar kısa sürede, damar yıkanarak ve damar yolu sık sık kontrol edilerek uygulanmalıdır.
- Eğer ekstravazasyon oluşursa, hemen infüzyon kesilmelidir. Kol yukarı kaldırılmalıdır ve o bölgeye vinkalar için ılık, diğer ajanlar içinse soğuk kompresler 24 saat süre ile uygulanmalıdır.
- Alopesi: En sık karşılaşılan cilt toksisitesidir. Alopesi antrasiklin, taksanlar ve siklofosfamid gibi ilaçların kullanımı sırasında sık görülürken, sisplatin, 5-fluorourasil, vinkristin, vinorelbin ve bleomisinde hafif derecede karşımıza çıkar.
- Diğer cilt toksisiteleri: Cilt pigmentasyonu, tırnak değişiklikleri, güneş ışığına karşı aşırı duyarlılık ve yara iyileşmesinde gecikme gibi yan ekiler genellikle klinik sorun oluşturmayacak derecede görülür.
- PULMONER TOKSİSİTE
- Bleomisin, nitrozüreler, metotreksat, sitozin arabinozid, mitomisin C, prokarbazin ve bazı alkilleyici ajanlarla bazı hastalarda akciğer toksisitesi görülmektedir.
- Bleomisinde dozu sınırlayan yan etki akciğer toksisitesidir. İlaç %10 oranında pnömonitis yapar.
- Steroid tedavisinden yarar görürlebilir. Bu toksisite ilerlerse, seyrek görülen ve ölümcül olan pulmoner fibrozise dönüşür ve etkin tedavisi yoktur.
- KARDİYAK TOKSİSİTE
- Doksorubisin, daunorubisin, epirubisin gibi antrasiklinlerde görülür.
- Konjestif kalp yetmezliği gelişebilir. (uzun vadede devam ederse)
- Doksorubisin ve doksorubisinol adlı metabolitin değişik mekanizmalar sonucunda, demir varlığında serbest radikallerin miyokard dokusunda oksidasyonu indüklemesi ile ortaya çıkar.
- NEFROTOKSİSİTE
- Sisplatin, ifosfamid, mitomisin C ve yüksek doz metotreksat bu yan etkileri gösterir.
- Sisplatin renal glomerüler filtrasyon hızında kalıcı bozulmaya yol açabilir ancak, renal tübüler fonksiyonlar genellikle düzelir.
- Böbrek fonksiyonlarındaki bozukluğa bağlı hipokalemi, hipokalsemi, hipomagnezemi, hiponatremi görülebilir.
- Nefrotoksisiteden korunmak için, sisplatin uygulaması intravenöz yolla 2-120 saatlik infüzyon şeklinde (en kısa infüzyon süresi 30 dakika) yapılmalıdır. Kronik diyaliz hastasında uygulama için sakınca yoktur ancak, ilaç diyalizata geçmez.
- HEMORAJİK SİSTİT
- İfosfamid ve yüksek doz siklofosfamid yan etkilerinde görülür
- İlacın aktif metaboliti olan akrolein, üriner epitelde spesifik toksisite oluşturur.
- Hemorajik sistiti önlemek için her zaman ilaçla birlikte mesna (sodyum-2-merkaptoethanesülfonat) ve parenteral sıvı tedavisi uygulanmalıdır.
- NÖROTOKSİSİTE
Kanser ilaçlarına bağlı nörotoksisite üç şekilde gözlenebilir.
- Periferik nöropati:
- En sık görülen nörotoksisitedir.
- Vinkalar, sisplatin, taksanlar, prokarbazin ve etoposid bu yan etkinin sık görülebildiği ajanlardandır.
- El ve ayak uclarında olan, simetrik parestezi, daha sonra halsizlik, kas ağrısı ve duyu kaybıdır. İlk motor bulgu Aşil tendon refleksi kaybıdır. Sonrasında düşük ayak şeklinde motor disfonksiyon görülür.
- Otonomik nöropati ise sıklıkla kabızlık, seyrek olarak ileus ve mesane atonisi şeklinde görülebilir.
- Santral nöropati :
- Akut ensefalit ifosfamid, L-Asparaginaz, yüksek doz metotreksat ve 5-fluorourasil uygulamalarında görülebilir.
- Konfüzyon, hallüsinasyonlar, konvülsiyon, koma ve çok seyrek ölüm şeklinde görülebilir.
- Ensefalopati geliştiğinde ilacı kesmenin yanında, antidotu olan metilen mavisini i.v.yolla uygulamak yararlıdır; ayrıca ifosfamidi % 5 dekstroz solüsyonları içinde infüze etmenin koruyucu etkisi olduğu bilinmektedir.
- İntratekal ilaç uygulamalarında görülen nörotoksisite: İntratekal metotreksat ve sitozin arabinozid uygulamalarında görülen nörolojik yan etkiler akut, subakut ve gecikmiş nörotoksisitedir.
KÖK HÜCRE TEDAVİSİ:
- Kök hücre tedavileri insanlarda 3 temel tipe ayrılır.
- vericinin bir başka kişi olduğu allojenik transplantasyon
- bireyin kendi kök hücrelerinin kullanıldığı otolog transplantasyon
- vericinin alıcının ikizi veya üçüzü olduğu sinjeneik transplantasyon.
- En verimli vericiyi bulmak üzere mikro sitotoksisite assay (MCA) yöntemi kullanılarak 6’da 6 uyum yakalanmaya çalışılır.
- En iyisi allojenik transplantasyondur çünkü kanserli hücre yoktur fakat buradaki sorun doku uyumsuzluğunun olabileceğidir. Böbrek, lösemi, miyelom ve lenfoma gibi kanser türlerinde bu tip tedavi başarıyla uygulanmaktadır.
- Otolog transplantasyonlar lösemi, multipl miyelom, lenfoma, meme ve testis kanserlerinin tedavisinde kullanılabilir.
- T hücreli lenfomalı hastalarda yapılan bir çalışmada hastaların 4 yıllık sağkalım sürelerinin otolog transplantasyon yapılanlarda allojenik transplantasyona göre daha yüksek başarı sağladığı ve %76’ya %54 gibi bir oran elde edildiği gösterilmiştir.
BİYOLOJİK TEDAVİLER:
- Aşağıdaki şekilde sınıflandıralabilir:
- Monoklonal antikorlar
- Kanser aşıları
- Anti tümörojenikler (kanserin büyümesini engelleyiciler)
- Anti anjiyogenikler (kan damarlarının büyümesini engelleyiciler)
- İnterferonlar ve interlökinler
- Gen terapi biyolojik tedavinin alt grupları olarak sınıflandırılabilirler.
İmmünoterapi:
- Bağışıklık sistemini harekete geçirip kanserli hücrelere saldırmasını sağlamaktır. Bu, vücudun kendi bağışıklık sistemini kullanarak yapılabileceği gibi, sentetik uyarıcılar (monoklonal antikorlar) ile de yapılabilir.
Antikor tedavileri:
- Monoklonal antikorlar, konjuge monoklonal antikorlar, çıplak monoklonal antikorlar ve bispesifik monoklonal antikorlar olarak sınıflandırılabilir.
- Hücrenin sinyallerini bloke ederek, immün sistemi tetikleyerek veya hücrelere ilaçları taşıyarak işlevlerini gösterirler.
- Konjuge monoklonal antikorların amacı radyoaktif bir partikül veya kemoterapi ilacını hücreye taşımaktır. Üzerlerinde taşıdıkları yükü hedef antijene bağlanarak boşaltırlar ve hücrenin spesifik olarak ölmesini sağlarken sağlıklı hücrelere olabildiğince az hasar verirler.
- Radyoimmünterapi(radyoetiketli antikorlar) radyoaktif molekülleri hücrelere taşıyabilirler. Örneğin, non-Hodgkin lenfoma’da bu tip tedavi yapılabilmektedir.
- Radyoaktif veya kimyasal olarak işaretlenmemiş olan çıplak monoklonal antikor ise en sık kullanılanlardır. Bunlar, immün sistemi hızlandırarak işlev yaparlar. Hangi hücrenin öldürüleceğini gösteren birer fener gibi çalışırlar. Over kanserinin tedavisinde kullanılan Alemtuzumab, meme kanserinde kullanılan Trastuzumab, böbrek, metastatik kolon, akciğer diğer birçok kanserin tedavisinde kullanılan Bevacizumab, kolon, baş boyun ve KHDAK’nin tedavisinde kullanılan Cetuximab gibi birçok çeşitli tipi bulunmaktadır . Blinatumomab gibi aynı anda iki proteine bağlanıp üzerlerinde iki monoklonal taşıyan antikorlar olan bispesifik monoklonal antikorlar ise akut lenfositik lösemi ve kronik kenfositik löseminin tedavisinde sıklıkla kullanılmaktadır.
Non-spesifik Kanser İmmünoterapileri:
- Bu tip tedaviler immün sistemi uyaran ve belli bir tipteki hücreyi hedeflemeyen tedavilerdir.
- Vücudun enfeksiyonlara karşı direncini arttıran interferonlar, B ve T hücrelerinin sinyalleşmesinde kullanılan ve hücrelerin büyümesinde rol oynayan interlökinler, kemik iliğinin kan hücrelerini üretmesini teşvik eden granülosit makrofaj koloni stimülan etmen (GM-CSF) bu tip tedavide kullanılan ajanlardır.
Kanser Aşıları (Hücre Bazlı Tedaviler):
- B ya da T hücrelerini uyararır.
- Human Papilloma Virüs (HPV) ve Hepatit B Virüsü (HBV) gibi virüslere karşı üretilmiş olan aşılar antikor üretmek üzere B lenfositleri tetikler.
- Bugüne kadar, etkinliği kesin olarak kanıtlanmış herhangi bir kanser aşısı üretilmemiştir. Dünya Sağlık Örgütü’ne (DSÖ-WHO) göre Amerikan Besin ve İlaç İdaresi (FDA), rahim kanserine neden olan HPV’ye karşı geliştirilmiş sadece 2 aşıya (Gardasil ve Cervarix) onay vermiştir.
- 2010 yılında, FDA metastatik prostat kanserine karşı kullanılabilecek ilk kanser aşısı olan Sipuleucel-T’yi onaylamıştır .
Kanser Büyüme Baskılayıcıları (İnhibitörleri):
- Büyüme faktörleri vücutta üretilen hücredeki alıcılarına bağlanarak hücrenin büyümesini veya ölmesini koordine ederler.
Büyüme etmenlerinden en çok bilinenler ve çalışılanlar
- Epidermal büyüme etmeni (EGF),
- Damar endoteli büyüme etmeni (VEGF),
- Fibroblast büyüme etmeni (FGF),
- Trombosit kökenli büyüme etmeni (PDGF) olarak sayılabilir.
- Yaptıkları engelleme tipine bağlı olarak büyüme baskılayıcılar tirozin kinaz inhibitörleri (TKİ), mTOR inhibitörleri, proteazom inhibitörleri, fosfoinositid-3 –kinaz (PI3K), histon deasetilaz inhibitörler olarak alt gruplara ayrılabilirler.
- Kinazlar, sadece fosfatlama yaparak yeni bağlana bölgeleri oluşturur. Protein bunun sonucunda aktifleşebilir ya da hiperfosfatlanma ile inaktifleşebilir.
- Tirozin kinaz inhibitörleri, akciğer kanseri gibi EGFR (+) kanserlerin engellenmesinde kullanılan Afatinib, kronik miyelositik lösemiye karşı kullanılan Bosutinib, KHDAK’de kullanılan Erlotinib ve Gefinitib dir.
- Hücre büyümesi, çoğalması, protein sentezi ve transkripsiyondan sorumlu bir serin/treonin kinaz olan mTOR (mammalian target of rapamycin)’un baskılanmasının kanserde görülen hücrenin kontrolsüz büyümesi ve çoğalmasının önüne geçebildiği bilinmektedir. Bu amaçla geliştirilen Everolimus ve Temsirolimus gibi iki ilaç, meme kanseri ve metastatik pankreas tümörlerinde kullanılmaktadır .
- Fosfatidilinositol-3-kinaz grubu proteinlerin İdelalisib gibi ilaçlarla baskılanması sonucu farklı kanser türlerinde etkin bir tedavi sağladığı gösterilmiş olup, Amerika Birleşik Devletleri’nde bu ilacın KML’ye karşı kullanımı yasal onay almıştır .
- Proteazomların (protein yıkım yeri) baskılanmasında kullanılan proteazom inhibitörleri ile multipl myeloma gibi kanser türlerinde tedavi sağlanmaktadır.
- Histon deasetilaz inhibitörleri, histonlardan asetil gruplarının çıkmasını (deasetillenme) engelleyerek hücrenin kontrolsüz şekilde bölünmesinin önüne geçebilmektedir. Vorinostat ve Romidepsin adlı histon deasetilaz inhibitörleri FDA tarafından onaylanmış olup, kutanöz T hücreli lenfoma tedavisinde kullanılmaktadırlar .
- Lenalidomid, Thalidomid ve benzeri birçok ilaç çeşitli kanser türlerinin tedavisinde antiangiogenetik olarak kullanılmaktadır.
Gen Terapi:
- Lipozom veya viral vektörlerin taşıyıcı olarak kullanıldığı in vivo ya da ex vivo olarak müdahale edilen yötemlerdir.
- Gen transferi sonrasında sokulan genler ya kromozomlara entegre olurlar ya da kromozom dışı elementler olarak (epizom) kalırlar.
- Geni kromozomun içine sokmanın en büyük avantajı kalıtsal tedavilerde kullanılabilecek şekilde kromozomda kalıcı hale getirmektir.
- Vektör kullanarak hücre içine istenen genin sokulmasında iki tip yöntem kullanılır
- Viral yöntemler
- Non-viral (viral olmayan) yöntem
Viral vektörler:
- Kısıtlı büyüklükte oldukları için taşıyıcıklıkları kısıtlıdır. Hastayı enfekte edebilir ya da immun sistemce öldürülebilir. Adeno vektörleri (AAV), herpes simplex virüsü (HSV), vaccinia, retrovirüs ve lentivirüs vektörleri en sık kullanılanlardır.
- siRNA ile desteklenmiş replikatif adenovirüslerin de kanser tedavisinde etkin olduğu bildirilmiştir
- Kanser tedavisinde kullanılan ilk gen terapi ürünü özellikle p53’ü (rAd-p53) eksprese etmek üzere tasarlanmış olan Gendicine’dir.
- AAV vektörlere büyük genlerin sokulması zordur ve klonlama kapasitesi düşüktür
- HSVler, Parkinson gibi nörodejeneratif hastalıkların tedavisinde kullanılmaktadır. Kanserde ise, farelerde ve insanlarda yapılan deneylerde tümör büyümesinin engellenebildiği gösterilmiştir.
- 1990 yılında yapılan ilk onaylanmış gen terapi çalışmasında Ashanti de Silva adlı 4 yaşındaki bir kızda Adenozin Deaminaz Eksikliği (ADA) başarıyla tedavi edilmiştir. 65 ve 4 yıl sonra bile ADA gen ifadesinin etkin bir şekilde devam ettiği gösterilmiştir.Kullanılan virus retroviral vektördür.
- Retroviral vektörler kullanılarak KHDAK ve melanoma tedavilerinde umut verici sonuçlar elde edilmiştir
- Lentivirüsler en büyük engel bağışıklık sistemi zayıf olan kişilerde HIV enfeksiyonlarına yol açabilmesidir. Bu yüzden şimdilik çok fazla tercih edilmemektedir.
Non-viral vektörler:
- Çıplak plazmid DNA’ları non-viral vektörlerin en basit örneğidir.
- Kolaylıkla çok miktarda üretilebilirler, toksisiteleri genelde düşüktür ve viral sistemlere oranla daha az maliyetlidirler.
- Non-viral vektörler ise sentetik polimerler veya lipidlerdir. Peptoidler (glisin oligomerleri ile kaplı DNA), katyonik moleküller ve DNA/stearil polilizin kaplı lipidler örnek olarak verilebilir.
- En büyük dezavantajı ise transfeksiyon potansiyellerinin viral vektörlere oranla daha düşük olmasıdır ancak hücre veya dokulara kesin olarak hedeflenebilirler.
- Çıplak DNA, lipozomlar, lipopleksler, nanopartiküller, doğrudan enjeksiyon, DNA tabancaları ile bombardıman, elektorporasyon, sonoporasyon, magnetofeksiyon ve oligonükleotidler kullanılarak istenen genin hedef hücreye/DNA’ya sokulması mümkündür.
Gen ekspresyonun hedeflenmiş İnhibisyonu:
- DNA’nın transkripsiyonunu DNA’nın çift ipliğine özgü komplementer oligonükleotidler kullanarak durdurmak
- RNA’ya özgü oligonükleotidler veya polinükleotidler kullanılarak RNA’nın post transkripsiyonel işlenme sürecini bozmak
- Posttranslasyonel süreçte protein üretimini durdurmaktır.
- Gen ekspresyonunu baskılamak için RNA interferans (RNAi) sistemleri veya küçük nükleolar RNAlar kullanılmaktadır. FDA 1998’de Fomivirsen’in, 2013’te ise Mipomersen’in kullanımını onaylamıştır.
- Kanser çalışmaları için halen devam eden birçok Faz I/II çalışmaları bulunmaktadır.
- 19-25 nükleotid uzunlukta olan kısa kodlama yapmayan diziler olan ve hücre çoğalması, apoptoz, hücre döngüsü kontrolünde önemli roller oynayan miRNAlar da kanser dahil olmak üzere çeşitli hastalıkların tedavisinde kullanılmakta ve deneysel çalışmalar devam etmektedir.
- Kanserin gelişmesine neden olan bir miRNA’ya onkomiR adı verilir.
Diğer tedavi yöntemleri:
- LED veya lazer ışık kullanılarak ışığa hassas ajanların uyarılması ve hücreler için toksisite yaratan fotodinamik tedavilerdir
- Kanserli hücrelerin 50-100oC gibi ısılara kadar ısıtılarak hücrelerin protein ve lipid bilayer yapısını bozarak öldürmeye dayanan radyofrekans ablasyon tedavisi
- Kanserli hücrelere aşırı miktarda oksijen gönderip toksik bir etki oluşturmayı hedefleyen hiperbarik oksijen tedavisi gibi yöntemler olarak sayılabilir.
KAYNAKLAR
- Li Y. Et al. LncRNA SNHG5: A new budding star in human cancers. Gene 749 (2020) 144724
- Taefehshok S et al. Cancer immunotherapy: Challenges and limitations. Pathology - Research and Practice 229 (2022) 153723
- Baykara O. Kanser Tedavisinde Güncel Yaklaşımlar. Balikesir Saglik Bil Derg Cilt:5 Sayı:3 Aralık 2016
- Gürel Ç, Nursal A,Yiğit S. Epigenetik ve Kanser. Turkiye Klinikleri J Radiat Oncol-Special Topics 2016;2
- Yokus B. ve Ülker D.Ü. Kanser BiyokimyasI. Dicle Üniv Vet Fak Derg 2012: 1(2): 7-18
- Mehmet Ali KISAÇAM, Penbe Sema TEMİZER OZA. Kanser Hücrelerinin Metabolik İhtiyaçları ve Bağımlılıkları. F.Ü.Sağ.Bil. Vet.Derg. 2017; 31 (1): 67 - 72 http://www.fusabil.org
- Dosan L, Dicle A. Sinyal iletimi mekanizmaları ve kanser. Hacettepe Tıp Dergisi 2004; 35:34-42
- Tıbbi Onkoloji. Editör: Prof. Dr. Fikri İçli. ANTIP Yayınları.
- Harrison's Principles of Internal Medicine 19th. Edition
- Fuente B. Et al Marine resources and cancer therapy: from current evidence to challenges for functional foods development. Current Opinion in Food Science 2019, 44:100805
 Tümör-ilaç etkileşimi: Tümör büyüdükçe ilaca olan duyarlılık azalır. Ayrıca döneme spesifik olmama bir dezavantajdır.
Tümör-ilaç etkileşimi: Tümör büyüdükçe ilaca olan duyarlılık azalır. Ayrıca döneme spesifik olmama bir dezavantajdır. 