 Ecz. Şeyma ŞAHİN
Ecz. Şeyma ŞAHİN
KANSER NEDENLERİ VE ETKİ MEKANİZMALARI
Serbest radikaller (ROS):
- Biyolojik sistemlerdeki en önemli serbest radikaller oksijenden oluşan reaktif oksijen türleridir (ROS).
- ROS hasarına karşı vücudun antioksidan savunma sistemi vardır ve bu denge ROS yönünde pozitif bozulur ise hücrede DNA hasarı dahil, hasarlar başlar. Hasarlı DNA ile mitoz bölünmeye devam etme kansere sebep olabilir.
- ROS’tan kaynaklanan DNA hasarı oluşumunun temelinde Halliwell’e göre iki mekanizma vardır
- Direkt olarak hidroksil radikali tarafından oluşturulan DNA zincir kırılımı, baz modifikasyonu ve deoksiriboz fragmentasyonudur. (fragmentasyon=ufak ufak parçalanma)
- Oksidatif stres sonucu oluşan endonükleaz (fosfodiester bağı kesen enzim, fosfodiester bağı=DNA ve RNA daki fosfatların şekerle yaptığı bağ) inaktivasyonu ile DNA fragmentasyonu
- ROS, protein ve lipid peroksidasyonu ile plazma membranında hücresel aktiviteleri etkileyerek yapısal değişiklikler oluşturabilir. ROS membrana bağlı protein kinazları, büyüme faktörleri ve reseptörlerini böylece de sinyal iletimini, onkogen aktivasyonunu ve baskılayıcı genlerin inaktivasyonunu etkileme yeteneğine sahiptirler.
Genetik:
- İnsersiyon: Genetikte bir DNA dizisine bir veya daha çok baz çiftinin eklenmesidir.
- İnversiyon: Kromozomda bir parçanın 180⁰ ters dönerek tekrar aynı kromozoma bağlanması şeklinde görülen kromozom anomalileri
- Delesyon: Genetikte bir kromozomun bir parçasının kopup, kaybolmasıyla meydana gelen kromozom anomalileri. Kopan parçadaki genler kaybolur yani eksilir ve ciddi genetik hastalıklara sebep olur. Kopan parça başka bir kromozoma bağlanmaz, yok olur. Hücre bölünmesine katılamaz.
- Nokta mutasyon: DNA nükleotit dizisinde oluşan ve gelecek nesile aktarılabilen değişiklikler. Bir veya birkaç nükleotitte meydana gelebilir.
- Epigenetik susturma: Genleri kapatma yöntemi. Genleri susturmak için hücre içerisinde birbiriyle etkileşime girebilen üç sistem vardır:
DNA metilasyonu,
Histon modifikasyonları
RNA bağlantılı susturma
Kanser oluşumunda en büyük role sahip 3 gen ailesi:
- Onkogenler
- Tümör baskılayıcı genler
- DNA tamir genleri
Onkogenler: Onkogen, kontrolünü kaybetmiş protein kodlayan genlerdir. Proto-onkogen ise mutasyonlar veya artmış gen ekspresyonu nedeniyle onkogene dönüşebilen, normal genlerdir. Proto-onkogenler, hücre büyümesi ve farklılaşmasını düzenleyen proteinleri kodlar.
En bilinen onkogenlere örnek olarak RAS, Erk, MYC gibi genler gösterilebilir.
Tümör baskılayıcı genler: Hasar durumunda DNA tamirini başlatan, tamir girişiminin başarısız olması durumunda apoptozu tetikleyen apoptozu tetikleyen gen gruplarıdır. Bunlardan en bilineni ve en çok çalışılanı TP53 genidir. (hücre döngüsünü düzenleyen bir transkripsiyon faktörüdür.)
Tümör baskılayıcı genlerin işlevinin kaybolması (Delesyonlar, nokta mutasyonları, epigenetik susturmalar, kromozomların düzgün ayrılamaması ve mitotik rekombinasyonlar v.b. nedenler ile) hücre döngüsündeki kontrol kaybolmasına ve sonuçta da karsinogeneze neden olabilirler.
DNA tamir genleri: Hasarlı DNA’yı tamir etmek üzere gerekli proteinleri o bölgeye çeken ve böylece genin işlevinin yeniden kazanılmasını sağlayan genlerdir. Tamir başarısız olursa apoptotik yolakla yok olmasını sağlar.
Ancak bu önemli gen grubundaki işlev kayıpları hücrenin kanserleşmesinde sıklıkla karşılaşılan bir problemdir. En çok bilinen DNA tamir genlerinden biri işlevinin bozulması nedeniyle meme kanserinin oluşmasına yol açan BRCA (breast cancer) genidir.
Epigenetik :
- DNA dizisinde değişiklik yapmadan gen ekspresyonunda meydana gelen kalıtsal değişiklikleri ifade eder.
- Epigenetik mekanizmalar memelilerde normal gelişim ve doku spesifik ekspresyon için gereklidir.
- Kanserde epigenetik düzenlenmenin bozulması gen fonksiyonunun değişmesine ve neoplastik oluşuma yol açmaktadır.
Epigenetik mekanizmalar ;
- DNA metilasyonu (tümör baskılayıcı genlerde fonksiyon kaybına neden olur)
- Histon modifikasyonları- asetilasyon ve metilasyon (kromatin yapısını etkileyerek gen ekspresyonunu değiştirir)
- Kodlamayan RNA’lar (ncRNA) (çift yönlü etkisi vardır)
***NcRNA’lar ökaryotlarda birçok temel düzenleyici fonksiyonları yerine getiren yeni sınıf RNA moleküllerini ifade eder. Uzunluklarına göre küçük ncRNA ve uzun ncRNA olmak üzere iki esas kısımda incelenebilir. Son yıllarda önemi anlaşılan ncRNA’ların farklı tipleri onkogenik veya tümör baskılayıcı gibi davranış gösterebilmektedir.
SORU: Son dönemlerde metilleyici ajanların öneminden bahsedilmektedir. Metilleme her zaman olumlu mudur?
CEVAP: Tüm genom hipometilasyonu (5-metilsitozin içeriği azalması) gibi bölgesel hipermetilasyonlarda kanser sebebidir.
DNA metilasyonu görevleri;
- Embriyonik gelişim
- Transposbl element inaktivasyonu
- Kromatin yapısının düzenlenmesi
- Genomik imprinting
- X kromozom inaktivasyonu
- Gen ekspresyonunun düzenlenmesi
- DNA, DNA metiltransferaz izoenzimlerince metillenir böylece transkrispsiyon engellenir ve gen sessizleştirilir. Hücre mitoza girdiğinde ise metilasyon özelliği yavru hücrelere aynen geçirilir. Metilasyon tümör baskılayıcı genleri inaktive eden esas mekanizmalardan birisidir.
- DNA hipermetilasyonu karsinogenezin erken evrelerinde oluştuğu için kanserde erken tanı amacıyla kullanılabilme potansiyeline sahiptir. Çeşitli doku (taze, parafine gömülü) ve vücut sıvılarında (kan, idrar, tükrük, gaita, bronşial sıvı, mide sıvısı vs) metilasyon saptanabilir. DNA metilasyon özelliği kemoterapötik ajanlara cevabı değerlendirmek için kullanılabilir bir belirteçtir.
- DNMT (DNA metiltansferaz) inhibitörleri genomun demetilasyonuna yol açarak, tümör oluşumunun azalmasına ve tümör baskılayıcı genlerde ekspresyon artışına yol açar. Bu ajanlar solid tümör ve hematalojik malignitelerin tedavisinde kullanılmaktadır.
Histon modifikasyonları
- DNA çekirdekte histon ve non-histon proteinlerden oluşan kromatin adı verilen bir nükleoprotein kompleksi halinde bulunur. Histonlar küçük molekül ağırlıklı, bazik proteinlerdir.
- Histonların N-terminal kuyruk kısımları metilasyon, asetilasyon, fosforilasyon, ubikutinasyon, sumolasyon, ADP ribozilasyon, deiminasyon ve prolin izomerizasyonu gibi en az sekiz farklı modifikasyon ile postranslasyonel gen düzenlenmesinde rol alırlar. Bu modifikasyonlar DNA ve histon proteinleri arasındaki etkileşimi değiştirebilir.
- Histon modifikasyonları geri dönüşümlü ve dinamiktir.
- Tek başına veya kombine olarak gen transkripsiyonu, X kromozom inaktivasyonu, heterokromatin oluşumu, mitoz, DNA tamir ve replikasyonu gibi epigenetik programlarının kodlamasında görev almaktadır.
- En çok çalışılan histon modifikasyonu asetilasyon ve metilasyondur.
- Histon asetilasyonu histon asetiltransferaz (HAT), deasetilasyonu histon deasetilaz (HDAC) enzimleri ile katalize edilir. Metiltransferaz (HMT), demetilaz (HDM), kinazlar, fosfatazlar, ubiquitin ligazlar ve deubiquitinazlar, SUMO ligazlar gibi diğer enzimlerce de kontrol edilmektedir.
- Kromatin değişikliklerinin tümör başlangıcı ve ilerlemesi boyunca oluştuğu gösterilmiştir. Örneğin; H4 histon proteininde asetilasyon kaybı ve metilasyon artışı karsinogenezin erken dönemlerinde yaygın görülen bir değişikliktir.
- Birçok kanser HAT ve HDAC aktiviteleri arasındaki dengenin bozulması ile meydana gelen moleküler değişimler görülür.
- Gastrik, kolon, prostat, nöroblastoma, renal, meme, servikal kanser gibi farklı kanserlerde ve kanser hücre hatlarında HDAC ekspresyon artışı saptanmıştır.
- “HDAC inhibitörleri” epigenetik hedefli potansiyel kanser tedavi ajanı olarak tedavi alanına girmiştir. Bu ajanlar histonların asetillenmesini arttırır, kanserde sessizleşen genlerin tekrar eksprese olmasını ve malign fenotipin geriye dönmesini sağlar.
Kodlamayan RNA’lar
- İnsan genomunun total genomun %2’sinden daha azına karşılık gelen, yaklaşık olarak 20,000 protein kodlayan genin bulunması, transkriptomun çoğunun kodlamayan RNA (ncRNA) ile yapılandığını desteklemiştir.
- NcRNA’lar proteine translasyonu olmayan RNA’lardır ve ökaryotlarda birçok temel düzenleyici fonksiyonları yerine getiren yeni sınıf RNA moleküllerini ifade etmektedir. NcRNA’lar hücresel savunma, transkripsiyonel gen sessizleştirilmesi ve kromozomların yeniden modellenmesi gibi birçok biyolojik olayda görev yapmaktadırlar. Bu mekanizma kanser dahil birçok hastalıkta bozulmaktadır.
- NcRNA’lar boyutlarına göre iki sınıfta incelenmektedir.
1) Kısa ncRNA’la
2) Uzun ncRNA’lar (lncRNAs)
- Kısa ncRNA’lar 50 nükleotid uzunluğundan daha kısa, lncRNA’lar ise 200 nükleotitten daha uzun olan ncRNA’ları ifade etmektedir.
Kısa ncRNA
microRNAs (miR, miRNA),
piwi-etkileşimli RNA (piRNA),
ribozomal RNA (rRNA),
kısa araya giren RNA (siRNA),
küçük Cajal body-spesifik RNA (scaRNA),
küçük nükleer RNA (snRNA),
küçük nükleolar RNA (snoRNA)
transfer RNA (tRNA) gibi birçok farklı şekilde karşımıza çıkmaktadır.
- Örneğin; miRNA genlerinin tüm genomun %1-2’sini oluşturur ve tüm protein kodlayan genlerin yaklaşık %50’sinin aktivasyonunu kontrol eder. Her miRNA yüzlerce mRNA’yı direk veya indirek etkileyebilir. Tüm insan malignitelerinde miRNA düzenlenmesinin bozulduğu gösterilmiştir.
uzun ncRNA
Sens
Antisens
İki yönlü
İntronik
İntergenik
- Uzun kodlamayan RNA’lar (lncRNA) nükleer veya sitozolik kısımlarda lokalizedir.
- Genellikle RNA polimeraz II (RNA PII) ile transkribe edilir fakat açık okuma alanına sahip değildir, intronik ve intergenik bölgelerde haritalanmıştır. Küçük ncRNA’ların aksine farklı türler arasında korunmuş değildir.
- Son çalışmalarda insan genomunda lncRNA sayısının yaklaşık 15 000 olduğu hesaplanmıştır ve çoğu lncRNA’da doku-spesifik ekspresyon özelliği olduğu bulunmuştur.
- İleti yolakları Hippo, NF-kB, epitelyal-mezenkimal geçiş, Wnt/β‐katenin ileti yolaklarıdır.
- Hem tumor supresor hem de onkogen etkinlik vardır.
- LncRNA’ların stres cevabı, gelişim, embryonik kök hücre potansiyeli, lokalizasyon, alternatif splayzing, kromatin yeniden modifikasyonu, hücre siklusu, migrasyon ve metabolizma gibi birçok biyolojik olayda önemli rolleri olduğu bilinmektedir. Kanser oluşumuna katkısı değişiktir. Kanser ilerlemesi sırasında onkogen veya tümör baskılayıcı olarak fonksiyon yaparlar.
KANSER GELİŞİM MEKANİZMASI
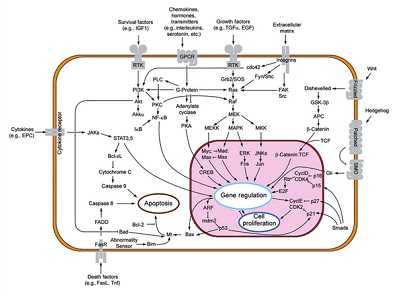
Şekil: DOI: 10.1158/1078-0432.CCR-12-0366
- Sinyalizasyon (hücrelerin bir hormon ya da büyüme faktörü ile uyarıldığında normal olarak aktif hale geçen devrelerin, bir daha kapanmadan sürekli bölünme ile devam etmesi)
- Apoptozis (Retinoblastoma ve TP53 genleri: apoptozis mekanizmasında 2 önemli gendir. Bu 2 mekanizma mutasyonla inaktif hale gelir ise apoptozis denilen hücre ölümü gerçekleşmez)
- Sınırlı bölünme mekanizmalarının (kromozomlar telomerler sayesinde belli sayıda bölünür, telomer; bölünme ile uzaklaşan DNA tekrarlarından oluşur. Tekrarlar bittiğinde hücre bölünme özelliğini yitirmiş yaşlı hücre olur. Kanserli hücrede telomeraz enzimi kromozoma yeni tekrarlar ekler ve hücre programlandığından daha fazla bölünür. )
bir ya da birden fazla mekanizmasının bozulmuş olması gerekmektedir. Kanser hücreleri, atipik metabolik özellik gösterir.
Hücre Siklusu ve Siklusa Etkili Faktörler- kanser ilişkisi:
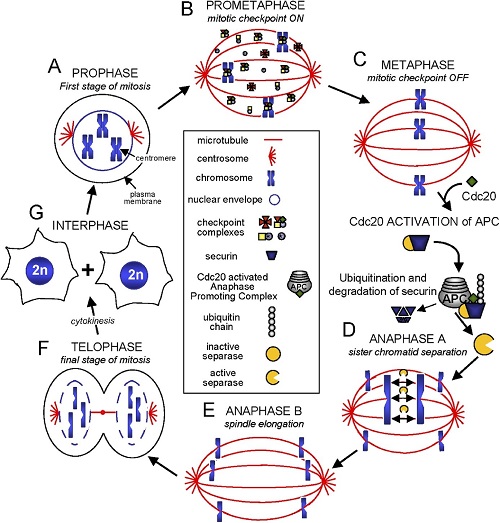
Weaver B.A.A, Cleveland D. W. Decoding the links between mitosis, cancer, and chemotherapy: The mitotic checkpoint, adaptation, and cell death. Cancer Cell, 2005
Hücre siklusu ana evre olarak 2 evreden oluşur. Bunlar; interfaz ve mitozdur.
İnterfaz kendi arasında 3 evreye ayrılır.
- G1 evresi (mitozdan sonraki ilk evredir. DNA sentezi yoktur ama RNA sentezi devam eder. Hücre büyümesi kontrol edilir. Yeterli olgunluğa gelip siklin ve siklin bağımlı kinazlarla büyü/ bölün işareti alınır ise hücre S fazına geçer. Hatalı DNA var ise p53 hücrenin ölüm sinyalini verir ve apoptoza gider. 11 saat süren evredir)
NOT: Hücrelerin bölünmemesi gerekir ise bu evrede G0 evresine alınır. Örneğin birçok epitel hücre G0 evresinde bekletilir.)
G1 evresinde, büyüme ve bölünmesi istenmeyen hücreler G0 fazına sokulur. Her bir evrede siklinler ve siklin bağımlı kinazlar vardır. Siklinler siklin bağımlı kinazları aktifleyerek ya da siklin bağımlı kinazlar hiperfosforilasyonla inaktiflenerek hücre döngüsünü kontrol eder. G1 evresinde oluşacak mutasyonla siklinler büyüme komutu (Büyüme faktörleri, sitokinler ve tümör virüsleri gibi mitojenik iletiler) alır ise hücre S fazına geçer, DNA kopyalanır ve bölünmeye hazırlanılmaya başlanır. G2 ve M fazında olan kontroller de durur ya da mutasyona uğrar ise kontrolsüz hücre bölünmesi başlamış olur. G-1 evresinde, saptanan DNA hasarı orta derecede ise tümör baskılayıcı gen (p53) tarafından p21 proteininin sentezlenmesi sağlanmaktadır. Siklin CDK kompleksi inhibe edilerek döngü G1 veya G-2 evresinde durdurulmakta veya askıya alınmaktadır. Eğer DNA hasarı çok büyük ise, p53 hücrenin apopitoze girmesine sebep olmaktadır.
- S evresi (DNA replikasyonu yapılır, kromozom çiftlenmesi, RNA ve protein sentezi görülür. Hücre içeriği 2 katına çıkar, sitoplazma yoğunluğunda değişiklikler görülür. 8 saat süren evredir )
- G2 evresi (Mitozdan önceki son basamaktır. Son kontroller yapılır. Eğer DNA hatalı kopyalandı ise, bölünme iptal edilir. Enerji harcanmaz, ATP depolanır çünkü yakında bölünme başlayacaktır. 4 saat süren evre)
- Mitoz ve sitokinez
Diğer evre olan mitoz kendi arasında yine 4 e ayrılır (mitozun tamamı 1-2 saat sürer)
- Profaz
- Metafaz
- Anafaz
- Telofaz
G1, G2 ve metafaz anafaz arasında kontrol noktaları bulunmaktadır. TAMAM MI? DEVAM MI KISMINA KARAR VERİLİR!
- S fazı etkili ilaçlar: antimetabolitler
- G2 spesifik: bleomisin, podofilotoksin( tenipozid- etopozid)
- M fazı etkili: bitkisel antineoplasitkler
- Hücre büyümesini uyaran moleküller, büyüme faktörleri ve sitokinlerdir.
- Büyüme faktörleri, hücre bölünmesini uyaran veya inhibe eden veya özelleşmiş hücreye farklılaşmasını başlatan peptidlerdir.
- DNA sentezi için, büyüme faktörü-reseptor etkileşimi yoluyla sinyal iletiminde yer alan faktörler, “mitogenesisin büyüme faktörü-proto-onkogen yolu” olarak isimlendirilen kaskat sistemini oluşturur.
- Bir büyüme faktörünün hangi işlevi başlatacağı hücre tipine ve hücre gelişim evresine göre değişmektedir.
- Polipeptid yapıda olan büyüme faktörleri, hidrofilik özellikte oldukları için hücre membranındaki özgün reseptörlere bağlanarak ve hücre içindeki ikincil habercileri uyararak etki ederler. (Gprotein bağlı reseptörler, enzim bağımlı reseptörler v.b.)
- Sitokinler, hemotopoetik hücrelerin inflamatuar ve immun yanıtının gelişimi ve düzenlenmesinde aracılık eden, peptid veya glikoprotein yapıda kimyasal ileti molekülleridir.
- Salgılandıkları hücreden kan dolaşımı ile hedef hücrelere taşınan sitokinlerin endokrin, parakrin, otokrin ve jukstakrin etkileri bulunmaktadır.
- Sitokinler hücre döngüsü ve büyümesindeki kontrol mekanizmasında etkili olmakta veya bu fonksiyonları üstlenen diğer moleküllerin üretimini uyarmaktadır. Mitoz, hücre göçleri, hücre yaşamı ve hücre ölümü olaylarında düzenleyicidirler. Janus kinazları aktive etmektedir (protein tirozin kinazlar)
-
- Protoonkogenler ve Onkogenler Protoonkogenler:
- Hücre sinyalinde birçok protein sentezinden sorumludur. Hücre ileti yollarındaki proteinleri kodlayan protoonkogenlerin (sis, hst-1, int-2, erb-B1, erbB2, fms, ret, ras, abl, myc, N-myc, cyclin D, CDK4 vb.) mutasyona uğramaları sonucunda,
- büyüme faktörlerinin çok fazla üretimi,
- hücre membranı ve çekirdek arasındaki ara yolların kontrolsüz uyarılması,
- transkripsiyon faktörlerinin sentezinin artması,
- hücre bölünmesine engel olunamaması gibi sonuçlar ortaya çıkmaktadır.
- Protoonkogenler proteinlerinin önüne c [cellular(c-Fos, c-Myc), onkogenlerin önüne ise v [viral (v-Fos, v-Myc)] ekleri getirilerek adlandırılmaktadır. Çünkü onkogenler ilk virüs zannedilmiş ama sonrasında mutasyona uğrayan yapılar olduğu görülmüştür.
- Normalde değişiklik oluşturmayan protoonkogenler; delesyonlar, eklentiler, gen amplifikasyonları, nokta mutasyonları, DNA yeniden düzenlenmeleri ve translokasyonlar gibi genetik değişimlerle aktive olarak, onkogen haline dönüşmektedirler.
- İnsan tümörlerinde en sık gözlenen onkogen anomalisi, ras geni mutasyonudur.
- İnsan tümörlerinde en yaygın bulunan myc geni (hücre büyümesi kontrol eder) , sinyal ulaştığında hücreyi hızla bölünmeye götürmektedir.
- DNA onarımından sorumlu genler de kanser oluşumunda hedef genler arasında bulunmaktadır. İlk bulunan kanser baskılayıcı gen, retinoblastoma (Rb) genidir. pRb, p53 veya p21 proteinini kodlayan genlerin her iki kopyasında bulunan mutasyonun, hücre büyümesinin baskılanmasını engellemesi sonucu tümör oluşmaktadır.
Hücre ölümü ve kanser ilişkisi:

Şekil: https://doi.org/10.12729/jbtr.2020.21.2.050
- Apoptoz programlanmış hücre ölümü olup programlı, düzenli ve temiz bir yöntemdir. Sadece intihar olarak düşünülmemelidir. Embriyolojik gelişimde ya da günlük hayatta karşılaştığınız bir olaydır. Örneğin, anne karnında fetüsün parmakların oluşması ya da menstrüel döngüdeki kanama birer apoptozis örneğidir.
- Nekroz ise ağrılı, sancılı, çevre hücre/ dokuları da etkileyen bir olaydır. Programlı, düzenli ya da istenen bir olay değildir.
- Apoptozis söz konusu olunca olay kaspazlar ile döner.
- Caspase: cisteine-aspartik asit proteaz dan gelmektedir.
Yani sistein ve aspartik asit yapısı parçalanır. Kaspaz 8 ve 9 başlatıcı kaspazlardır. Kaspaz 3 devereye girmiş ise artık hücre kurtulamaz ve ölür. Ama 8 ve 9 da hücre ölümünü durdurabilmek söz konusudur. BcL (kaspaz aktivasyonu düzenler) ailesi diğer kontrol edendir.
- Hücrenin yaşaması apopitozu uyaran ve inhibe eden genlere bağlıdır. Bu genler; Bcl-2 (antiapoptotik), Bax ve p53 (apoptotik) genleridir.
Sinyal transdüksiyonu ve kanser ilişkisi:

DOI: 10.1371/journal.pmed.0020013.g00
- Tirozin ve serin/treonin kinazlar- membran yerleşik
- Reseptör tirozin kinazlar (RTK) -membranda yerleşik / 58 adet (insülin reseptörü, büyüme faktörleri (EGF, VEGF, PDGF, FGF, NGF) reseptörleri ve efrin reseptörleri (EphA, EphB) yer almaktadır.
- Sitoplazmik protein kinazlar: Src, Abl, fokal adezyon kinazı (FAK) ve “Janus Family Kinases (JAK)” proteinleridir. Sitoplazmik tirozin kinazların sürekli aktivasyonu ve onkojenik sinyal iletimi, transformasyon, tümör büyümesi, motilite ve invazyon artışı ile anjiyogenez gibi malign fenotipe özgü hücresel olayları hızlandırır
- Karsinogenez sürecinde ise, sürekli ve kontrolsüz RTK aktivitesi söz konusudur
- Protein kinazlar dört mekanizma aracılığıyla onkojenik transformasyona yol açabilir.
1. Protoonkogenin retroviral transdüksiyonu
2. Genomik rearanjmanlar
3. “Gain of function (GOF)” mutasyonlar
4. Protein kinazın aşırı sentezlenmesi.
- Örneğin; İmatinib mesilat (Glivec), kronik miyelositer lösemide bu proteinin kinaz aktivitesini inhibe etmektedir.
- Protein kinazların devamlı aktivasyonuna yol açan GOF mutasyonlara Src tirozin kinaz ve c-kit örnek verilebilir. Src tirozin kinaz proteininin c-ucunda meydana gelen kısalma, proteinin inaktif hale dönmesini önler ve onkojenik potansiyel kazandırır . c-kit (Proto-onkogen c-KIT, tirozin-protein kinaz KIT, CD117 veya mast / kök hücre büyüme faktörü reseptörü olarak bilinen reseptör tirozin kinaz proteinini kodlayan gendir. ) protoonkogeninde ise, nokta mutasyonu sonrası sürekli kinaz aktivasyonu söz konusudur. İmatinib mesilat, gastrointestinal stromal tümörlerde de c-kit kinaz aktivitesini baskılamaktadır .
- Tümör hücrelerinde, protein kinaz sentezinin artması da onkojenik transformasyonda etkili olmaktadır. Örneğin; Erb-B reseptör ailesinde yer alan proteinlerin (örneğin; EGFR, HER2) sentezinin artması akciğer kanseri patogenezini doğrudan etkilemektedir. Meme karsinomalarında da HER2/neu sentezi artmaktadır.
- Tümör hücresi büyüme faktörleri reseptörlerini bloke eden monoklonal antikorlar (örneğin, Herceptin) veya doğrudan tirozin kinaz aktivitesini inhibe eden ilaçlar (örneğin, Glivec) ile klinik çalışmalar yürütülmektedir
- MAP kinaz sinyal iletim yolu MAP kinazlar, “Mitogen-activated protein kinases” süper ailesinde yer alırlar. Bu sinyal iletimi kaskadları, embriyogenezis, yaşama, çoğalma, diferansiasyon ve apoptozis işlevlerinin düzenlenmesinde rol alır. MAP kinaz yolunu (Ras/Raf/MEK/ERK sinyal iletim yolu)Hormonlar, büyüme faktörleri, diferansiasyon faktörleri ve tümör promoter maddeler bu sinyal yolunu kullanırlar.
- Onkojenik Ras, PI-3K yolunun (PI-3 kinaz/protein kinaz B sinyal iletim yolu ve kanser Fosfoinozitid-3 kinaz (PI-3K) ailesi, büyüme ve yaşama sinyallerinin iletiminden sorumlu proteinlerdir) güçlü bir aktivatörüdür. (normalde bu etkinlik düşüktür.) Onkojenik Ras bu yolu aktive ederek apoptozisi baskılar. Sitokinler ve büyüme faktörleri PI-3K ve PKB yolunu aktive ederek hücreler için yaşama sinyalleri oluştururlar. Tümör baskılayıcı proteinlerden PTEN ise, PIP3 oluşumunu inhibe ederek negatif düzenleyici rol oynar. Protein kinaz B ((PKB sentezi kanser hücrelerinde (meme, over, mide, pankreas, prostat) artabilir.)uyarısı hücre içinde çeşitli proteinlerin aktivitelerini etkilemektedir. Bunlardan biri, “mammalian target of rapamycin (mTOR)” proteinidir. Kinaz aktivitesine sahip olan bu proteinin rapamisin tarafından inhibe olduğu gösterilmiştir.
- Protein kinaz B (PKB) ayrıca p21’in stabil formunun oluşumunu tetikler ve hücre döngüsünün ilerlemesine uyarıcı yönde etki eder ve p21’in degradasyonunu uyaran proteini de inhibe etmektedir. P 27 etkinliğini de ortadan kaldırır. P 27 hücre döngüsünde siklin ve siklin bağımlı kinazlara bağlanarak inhibitör etki yapar. Bu etkinlik ortadan kalkar. Ve hücre kontrolsüz bölünmeye devam eder. PKB, proapoptotik BAD proteini ile kaspaz 9 üzerinde inhibitör etki gösterirken, NFκB uyarısı ile de antiapoptotik cevabı desteklemektedir.
NOT: mTOR a etki eden diğer ilaç rapamisindir. Yani organ nakli ilacıdır. Rapamisinin, mTOR sentez artışı görülen tümörlerde antitümör etki gösterdiği bildirilmektedir. Rapamisin, PKB aktivesine etki etmemektedir.
- Src tirozin kinazın ekspresyonu ve/veya aktivitesi artmaktadır. Kanser hücrelerinde Src aktivasyonunun kontrolünün ortadan kalkması tümör büyümesini hızlandırabilir ve hücrelerdeki invazyon potansiyelini uyarabilir.
- Ras ve Raf protoonkogendir.
- Raf kinaz inhibitörleri ile yapılan çalışmalar Faz I-II aşamalarında sürmektedir. İnsan tümörlerinin %30’unda Ras/Raf/MEK/ ERK yolunun aşırı aktivasyonu söz konusudur. Bu oran tümörlerdeki Ras mutasyonu sıklığı ile uyumludur. Mutant Ras proteinleri, aktif RAS-GTP formunda kalırlar; bu nedenle, hücrenin kontrolsüz uyarılmasından sorumlu tutulmaktadırlar.
- Farnezil transferaz inhibitörleri Ras aktivasyonunu önlerler. Klinik çalışmalar, bu ajanların antitümöral etkilerinden tedavide yararlanılabilme olasılığını güçlendirmektedir
- JAK/ STAT yolu
STAT: Signal transducer and activator of transcription proteinleri
JAK: Janus kinase
Devamlı olarak aktif olan STAT proteini antiapoptotik yolları uyararak malign süreçte etkili olabilir.
Örneğin; IL-6 ile devamlı STAT3 aktivasyonu uyarılan multipl miyeloma hücrelerinde antiapoptotik proteinlerden Bcl-xL ve Mcl-1’in arttığı gösterilmiştir. STAT aracılı sinyal iletimi ile uyarılan hedef genlerin (örneğin; c-myc, siklin D1 ve Bcl-xL) hücre döngüsünün kontrolünü sağlayarak ve/veya apoptozisi önleyerek karsinogenez sürecinde etkili oldukları öne sürülmektedir. Ayrıca, STAT aracılı sinyal iletiminin malign sürecin gelişiminde MAP kinaz yolunun aktivasyonu ile etkileşebileceği düşünülmektedir. Devamlı aktif STAT3 proteini ile hastalıksız sağkalım süresi arasındaki ters ilişki anlamlı bulunmuştur
Lösemik blastlarda sitokin sentezi ve otokrin/parakrin yolla JAK/STAT yolunun uyarılması, akut miyeloid lösemide devamlı STAT aktivasyonu nedeni olabilecek mekanizmalar arasında sayılmaktadır STAT3 aktivitesi vasküler endotelyal büyüme faktörü (VEGF) düzeyinin artışına yol açarak, tümör anjiyogenezisinde de rol oynamaktadır.
Devamı 15 Mart Salı günü gelecek...
Kaynak;
- Li Y. Et al. LncRNA SNHG5: A new budding star in human cancers. Gene 749 (2020) 144724
- Taefehshok S et al. Cancer immunotherapy: Challenges and limitations. Pathology - Research and Practice 229 (2022) 153723
- Baykara O. Kanser Tedavisinde Güncel Yaklaşımlar. Balikesir Saglik Bil Derg Cilt:5 Sayı:3 Aralık 2016
- Gürel Ç, Nursal A,Yiğit S. Epigenetik ve Kanser. Turkiye Klinikleri J Radiat Oncol-Special Topics 2016;2
- Yokus B. ve Ülker D.Ü. Kanser BiyokimyasI. Dicle Üniv Vet Fak Derg 2012: 1(2): 7-18
- Mehmet Ali KISAÇAM, Penbe Sema TEMİZER OZA. Kanser Hücrelerinin Metabolik İhtiyaçları ve Bağımlılıkları. F.Ü.Sağ.Bil. Vet.Derg. 2017; 31 (1): 67 - 72 http://www.fusabil.org
- Dosan L, Dicle A. Sinyal iletimi mekanizmaları ve kanser. Hacettepe Tıp Dergisi 2004; 35:34-42
- Tıbbi Onkoloji. Editör: Prof. Dr. Fikri İçli. ANTIP Yayınları.
- Harrison's Principles of Internal Medicine 19th. Edition
- Fuente B. Et al Marine resources and cancer therapy: from current evidence to challenges for functional foods development. Current Opinion in Food Science 2019, 44:100805
Yazının birinci bölmünü okumak için linke tıklayınız.
https://www.eczacininsesi.com/dosya-detay.php?id=1072
 Ecz. Şeyma ŞAHİN
Ecz. Şeyma ŞAHİN



