 Ecz. Şeyma ŞAHİN
Ecz. Şeyma ŞAHİN
- Latince yengeç anlamına gelen ''canker'' veya ''carcinos'' kelimelerinden türemiştir. Tümör terimi ilk defa ilk defa MÖ 3. yüzyılda tümörün etrafındaki şişmiş damarları bir yengecin bacaklarına benzettiği için Hipokrat tarafından kullanılmış, Yunan doktor Galen ise şişme anlamına gelen “oncos” terimini kullanmıştır.
- Hücrelerin kontrolsüz bölünmesi ve çoğalması ile ortaya çıkan ve genetik ve çevresel koşulların etkisi altında olan kompleks bir hastalık. Şimdilik bilinen 100’den fazla çeşidi var.
- 2018 yılında 9.6 milyon kişini ölümüne neden olan ve ölüm nedenlerinde 2. Olan kanserin 2040 yılında 29.5 milyon yeni vaka yaratması beklenmektedir.
- Kanser hücrelerinin kendi metabolizmaları vardır:
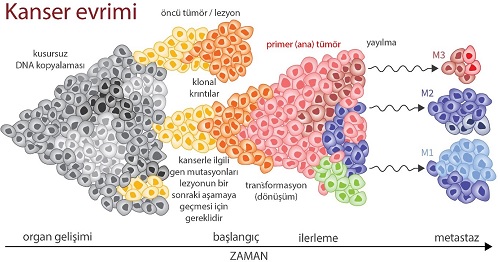
Şekil: www.drozdogan.com/kanserin-evrimi-tumor-nasil-evrimlesir
Hızlı çoğalan tümörler, bir molekül glikozdan elde edilecek ATP miktarının çok az olmasına rağmen glikozu aerobik ortamda laktata dönüştürmektedir. Kanser hücrelerinin bu özelliği "Warburg Etkisi" ya da “aerobik glikolizis” olarak adlandırılmaktadır.
“Glikozun artan alımı ve yıkımın laktat yönünde olmasının biyokütle birikimini desteklemeye ve çoğalan hücrelerde redoks dengenin korunmasına yönelik olduğu ileri sürülmektedir.”
Aslında önemli olan burada laktat; hücre göçünü, yeni damar ağlanmasını, immun sistemden kaçışı ve radyoaktif direnci geliştirerek tümör invazyonunu arttıran bir ajan olarak rol oynamaktadır. Glikolizin laktat metabolizmasına kaçma isteği şu yollarlarla açıklanır:
- spesifik membran (GLUTs)
- laktat taşıyıcıları (MCTs)
- glikozun ve ile glikolitik yolağın çoğu efektörünün aşırı ekspresyonu
- laktata dönüşmesinde görev alan sorumlu enzimlerin de artışı (glikoliz enzimlerinin bazılarının izoenzimleri)
*hekzokinaz mitokondri membranından sitokrom c (hücre ölümü demektir) salınımını önler. Böylece hücre ölüm sinyali alamadığı için apoptozisten kaçar.
*fosforuktokinaz 2 nin hem kinaz hem fosfataz aktivitesi vardır. Fosforuktokinaz 2/ früktoz-2,6- bifosfataz ailesine ait 4 izoenzim arasından PFKFB3 hipoksik tümörlerde aşırı üretilmekte ve kinaz aktivitesinde artışa neden olmaktadır.
*Fosfogliserat mutaz, enolaz izoformu, purivat kinaz izoformu tam etki mekanizması bilinmese de kanser dokusunda regülasyonunun arttığı rapor edilmiştir.
*Laktat dehidrogenaz izoformlarından LDH-A invazif glikolitik kanserde aşırı ekspresyonuna neden olmaktadır.
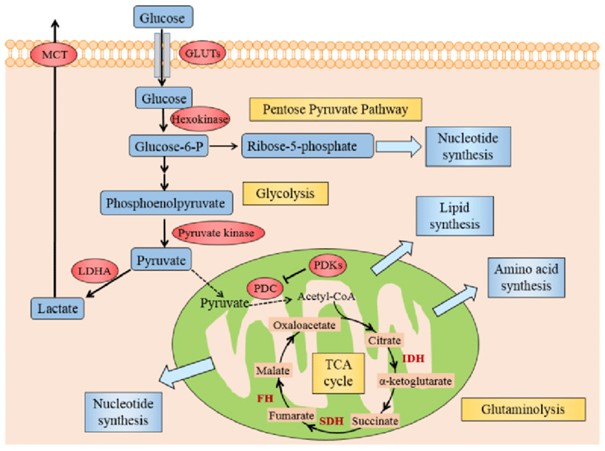
Şekil: DOI:10.7150/ijbs.13325
Son yıllarda glutaminin, çoğalmada önemli ölçüde enerji sağlayan kritik besin olduğu anlaşılmıştır. Glutamin insan serumunda en fazla bulunan aminoasittir. Glutamin metabolizması, kanser hücrelerinin devamlı büyüme ve prolifere olma yeteneğine ATP üretimini, protein, lipit ve nükleik asit biyosentezini destekleyerek katkıda bulunmaktadır. Aynı zamanda redoks metabolizması düzenler ve sinyal iletim yolağında görev alır. Glutamin çoğalan hücrelerde anapletrotik substrattır (ara ürün derişimini arttıran) Örneğin, c-Myc’i onkojenik düzeylerde eksprese eden hücreler glutamin tükenmesinde ölürler.
Zayıflatılmış pentoz fosfat yolu ( nükleik asit sentezi için pentoz fosfatları üreten ve ayrıca NADPH üreten yolak – NADPH anabolizma reaksiyonlarında gereklidir) da kanserli hücreler için uygun ortam oluşturur. Çünkü NADPH ve ribuloz 5 fosfat üretimi oksidatif strese karşı da koruma sağlar.
Serin ve glisin metabolizması: Tek karbon metabolizması (serin glisine dönüşür- serin hidroksimetiltransferaz enzimi ile) ile hem kendisi hem de glisin, protein, nükleik asit ve lipid öncülleri sentez edilir. Aynı zamanda serin biyosentezinin düzenlenmesi antioksidan kapasiteyi direkt kontrol eder. Glisin ise glutatyonun, proteinlerin, pürinlerin ve DNA/histon metilasyon biyosentezi için gereklidir.
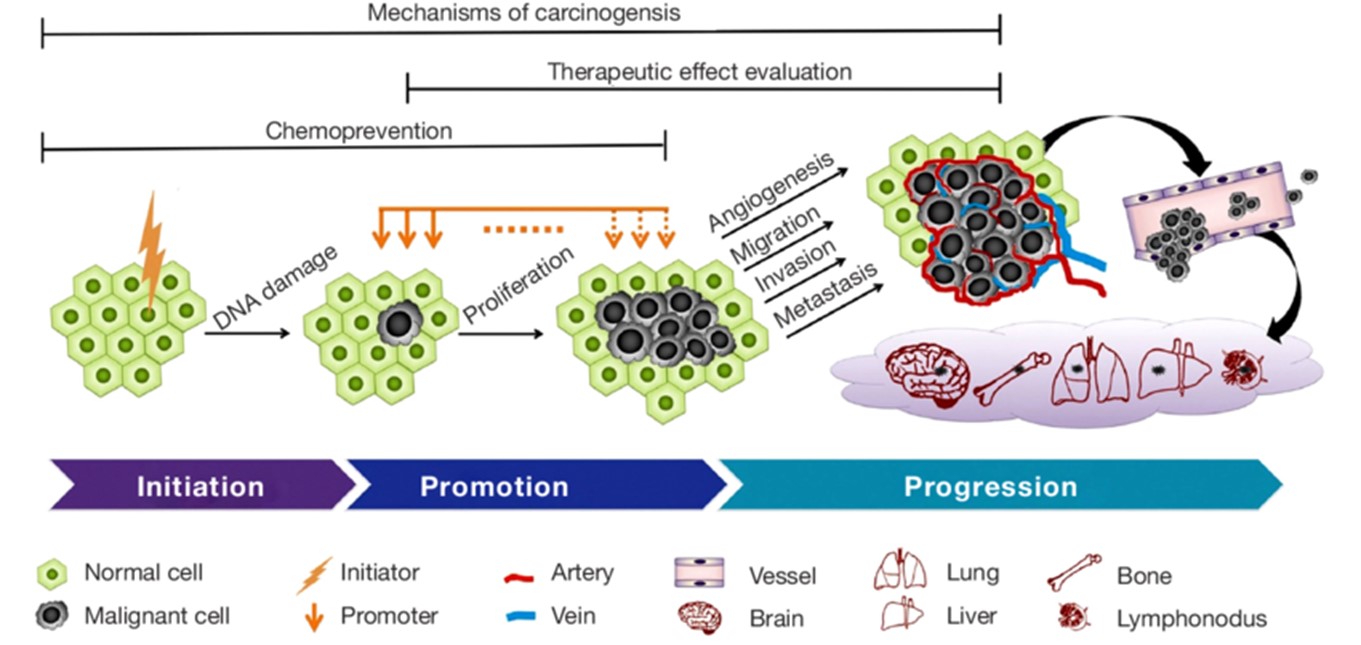
Şekil: doi: 10.3978/j.issn.2223-4292.2015.06.01
- Sağlıklı hücreler; dış membrandan sinyal aldıklarında büyür ve bölünerek çoğalırlar. Dışarıdan gelen sinyaller hücre içine girip nükleusa aktarılır ve süreç başlar. Hücre bölünmeden önce çevresini kontrol eder ve yeterli miktarda besin olup olmadığını, büyüyecek yer olup olmadığını kontrol eder ve şartlar uygunsa büyümeye başlar. Önceden belirlenmiş olan boya ve sayıya gelene kadar büyürler ve birbirlerine temas ettikleri anda büyümeyi durdururlar. Buna, kontak inhibisyon (temasa bağlı büyümenin durması) denir. Kanser hücrelerinde kontakt inhibisyon rotadan kalkmıştır.
- DNA’nın veya hücrenin elemanlarından birinin hasarlı olması hücreler büyümeyi ve bölünmeyi durdurarak tamir edilmek üzere G0 fazı adı verilen evreye geçerler. Hücre burada gerekli düzenlemeler ile tamir edilirse tekrar dolaşıma girer ve yaşamına devam eder. Ancak tamir edilemeyecek kadar hasar almış olması durumunda, apoptoz adı verilen mekanizma ile programlı bir şekilde ölüme gönderilir veya immün sisteme ait hücreler hasarlı hücreyi yiyerek yok eder. Böylece hasarlı DNA’nın sonraki nesillere aktarılması engellenmiş olur. Ama bu mekanizma bozulur ise bölünme devam eder ve DNA- yapısı bozuk hücreler meydana gelir.
Kanser hücreleri ise normal hücrelerin sahip olmadığı birçok özelliğe sahiptir:
- Hücre yüzeyindeki almaçlar (reseptörler) daha sık sinyal alır.
- Kontrolsüz şekilde çoğalmayı sağlayan kendi sinyal sistemleri vardır.
- Yandaki hücreye temas sonrası bölünmeyi durdurmaz ve büyümeye ve çoğalmaya devam eder.
- Sağlıklı hücreler her tipteki besini kullanabilirken kanser hücreleri sadece glikolizden gelen glukozu kullanabilirler. Şekeri normal hücreler oranla yaklaşık 100 kat fazla olarak kandan alırlar ve laktat üreterek enerji sağlarlar. (Warburg etkisi)
- Gerekli besin ve oksijeni almak üzere çevrelerindeki stromayı etkileyerek yeni damar sistemleri oluşturabilirler (neo-vaskülarizasyon)
- Telomerlerini sabitleyerek veya telomeraz aktivitesini koruyarak sonsuz şekilde replike olup çoğalabilirler.
- Dolaşım sistemine girip uzaktaki bir yere hareket edebilir ve yeni bir yere yerleşerek kanserleşmeyi başlatabilirler (metastaz)
- Apoptozdan kaçabilirler.
- Genetik ve epigenetik olarak stabil değildirler.
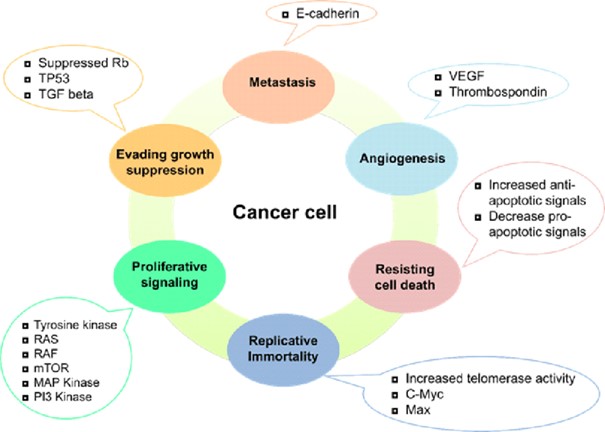
Şekil: https://doi.org/10.12729/jbtr.2020.21.2.050
- Kanser hücreleri zeki hücrelerdir çünkü az oksijen, az yiyecek, zorlu koşullara karşı gösterdiği direnç ve zaman içerisinde bu koşulları kendi lehine çevirmesi ile yaşama tutunur. Kanser hücreleri zamanla şekil değiştirebilir.
- Normal hücrelerin belli bir zemine tutunarak büyümesi ve yaşaması mümkünken, kanser hücreleri herhangi bir yere tutunmadan da yaşayabilir ve büyüyüp çoğalabilirler.
- Birçok kanser türü başlangıçta belirti vermez ve her kanser türünün aynı olmadığı unutulmamalıdır. Kanserin tipine bağlı olarak görülen genel belirtiler değişiklik gösterebilir. Bu nedenle her kanser türüne yaklaşım farklı olmaktadır.
- Ailesinde kanser hikayesi olan kişilerin rutin kontroller konusunda daha hassas olması gerekir. Röntgen, kan testleri, bilgisayarlı tomografi taramaları, manyetik rezonans görüntüleme (MRI), endoskopi ve genetik görüntüleme testleri kanserin erken teşhisinde kullanılabilecek araçlardır.
- Özellikle virüslerin neden olduğu bazı kanser türlerinin engellenebilmesi adına, çeşitli aşılar geliştirilmiştir. Örneğin; HPV-rahim ağzı kanseri
- Genetik testler önem kazanmaktadır. Mesela;
Meme ve over kanseri için BRCA1 ve BRCA2
Meme, sarkom, lösemi ve birçok başka tip için TP53
Over, kolorektal, endometriyal, beyin kanserleri için MSH2, MLH1, MSH6
Kolon ve rektum, ince bağırsak, mide, cilt kanserleri için APC
Göz, kemik, cilt için RB1 genlerindeki değişimler genetik testler için saptanabilir.
- Tüm kanserler, DNA dizisindeki anormalliklerle oluşmaktadır. Kanserlerin %10- 15 inin kalıtımsal olduğu, geriye kalan %85-90’ lık kısmını ise epigenetik ve çevresel faktörlere bağlı geliştiği düşünülmektedir. Bakteri, virüs (Helicobacter pylori, T hücreli lösemi virüsü, human papilloma virüsü)ilaçlar, kırmızı etçe zengin beslenme, küfler, iyottan fakir beslenme, yağlı yiyecekler, radyasyondan v.b. çevresel faktörlerden beslenme alışkanlığına ve kimyasallara kadar birçok faktör etkilemektedir.

- İyonize radyasyon gibi ışınımlar (x, gama ışınları, nükleer emisyonlar, Ultra viole ışınları DNA’da tek ve çift zincir kırıkları ile baz ya da şekerde modifikasyonlara sebep olur. Son yıllarda elektirikli ev aletlerinden yayılan, düşük ve yüksek frekanslı manyetik alanların da (noniyonize ışınımlar) DNA üzerinde hasar oluşturduğuna dair çalışmalar mevcuttur. Çok düşük frekanslı elektro magnetik alanın (EMF-MF) (50 Hz, 0.97 mT) lökosit DNA’sında 8-Hydroxy-2’-deoxyguanosine düzeyini artırdığı yönündedir. Anlamı; DNA’da G-C, A-T dönüşümüne sebep olarak, ELF-MF’nin prekanserojenik etki göstermesidir
- Örneğin, kalın bağırsak kanserinde genetik yatkınlık söz konusu olsa da asıl etken, %85-90 oranında doğumdan sonra kişinin yaşadığı mutasyonlardır.
- Ayrıca cinsiyete göre görülme şiddeti değişen kanserlerde mevcuttur mesela, sigara içen kadınlarda akciğer kanserine yakalanma olasılığının erkeklere göre 3 kat fazla olmasının nedeni olarak gösterilen yüksek östrojen seviyesidir. Benzopiren birikimi kadınlarda daha fazladır. “benzopiren” (bir epoksit’dir) hücre içine girerek, burada DNA’yı oluşturan dört bazdan biri olan guanin ile bağlanır. Replikasyon sırasında guanine bağlanmış olan epoksit yüzünden guanin, timin olarak algılanır ve bunun sonucunda karşısındaki eşlenik bazda sitozin yerine adenin olur (GC, AT dönüşümü). Oluşan bu mutasyonlar, Ras (GTP bağlı monomerik GTP azlar) yolağını etkiler, sinyal hücre bölünmesinde fren görevi yapan p53 geninde oluştuğunda artık akciğer hücreleri durmadan bölünerek tümor oluştururlar.
Tedaviler şimdilik standart olmasına rağmen, hastalık BİREYSEL ANLAMDA FARKLILIKLAR GÖSTERMEKTEDİR. BU YÜZDEN TEDAVİLER HERKESE EŞİT ŞEKİLDE CEVAP VEREMEMEKTEDİR.
Tümör oluşumu 2 aşamalıdır:
- Neoplastik dönüşüm (baz çifti değişikliklerini, mispairing, delesyon, translokasyonlar ve amplifikasyonlar): DNA replikasyonunun ve tamir mekanizmalarının düzgün çalışmaması sonucu hücrelerde oluşan mutasyonlar. Mutasyonlar, büyüme kontrolünün kaybı ile sonuçlanarak, proto-onkogenler, tümör baskılayıcı genler, tümör baskılayıcı genleri düzenleyici genler ve büyümeyi kontrol eden genlerde oluşur.
- Neoplastik gelişim(kanser hücresinin klonal proliferasyonuna yol açarak, önce çevre dokulara sonra da uzak dokulara yayılarak büyümesini sağlar)
Devamı gelecek...
KAYNAKLAR
- Li Y. Et al. LncRNA SNHG5: A new budding star in human cancers. Gene 749 (2020) 144724
- Taefehshok S et al. Cancer immunotherapy: Challenges and limitations. Pathology - Research and Practice 229 (2022) 153723
- Baykara O. Kanser Tedavisinde Güncel Yaklaşımlar. Balikesir Saglik Bil Derg Cilt:5 Sayı:3 Aralık 2016
- Gürel Ç, Nursal A,Yiğit S. Epigenetik ve Kanser. Turkiye Klinikleri J Radiat Oncol-Special Topics 2016;2
- Yokus B. ve Ülker D.Ü. Kanser BiyokimyasI. Dicle Üniv Vet Fak Derg 2012: 1(2): 7-18
- Mehmet Ali KISAÇAM, Penbe Sema TEMİZER OZA. Kanser Hücrelerinin Metabolik İhtiyaçları ve Bağımlılıkları. F.Ü.Sağ.Bil. Vet.Derg. 2017; 31 (1): 67 - 72 http://www.fusabil.org
- Dosan L, Dicle A. Sinyal iletimi mekanizmaları ve kanser. Hacettepe Tıp Dergisi 2004; 35:34-42
- Tıbbi Onkoloji. Editör: Prof. Dr. Fikri İçli. ANTIP Yayınları.
- Harrison's Principles of Internal Medicine 19th. Edition
- Fuente B. Et al Marine resources and cancer therapy: from current evidence to challenges for functional foods development. Current Opinion in Food Science 2019, 44:100805
 Ecz. Şeyma ŞAHİN
Ecz. Şeyma ŞAHİN



